এসএসসি রসায়ন অধ্যায় ৩ পদার্থের গঠন সৃজনশীল প্রশ্ন ও উত্তর
এসএসসি রসায়ন অধ্যায় ৩ পদার্থের গঠন সৃজনশীল প্রশ্ন ও উত্তর
গুরুত্বপূর্ণ সৃজনশীল প্রশ্ন ও উত্তর
প্রশ্ন -১ : নিচের উদ্দীপকটি পড় এবং প্রশ্নগুলোর উত্তর দাও :
একটি মৌলের পরমাণুর মডেল আঁকার জন্য বলা হলে নবম শ্রেণির ছাত্র ফরিদ নিচের চিত্রটি অঙ্কন করল।
ক. পারমাণবিক সংখ্যা কাকে বলে?
খ. এবং
পরমাণু দুইটির নিউক্লিয়ন সংখ্যা সমান কিন্তু নিউট্রন সংখ্যা ভিন্নÑ ব্যাখ্যা কর।
গ. ফরিদের আঁকা মডেলটি যে পরমাণু মডেলকে নির্দেশ করে তা ব্যাখ্যা কর।
ঘ. অঙ্কিত মডেল অনুসারে পরমাণুর স্থায়িত্ব সম্পর্কে যৌক্তিক মতামত দাও।
কোনো মৌলের পরমাণুর নিউক্লিয়াসে বা কেন্দ্রে যত সংখ্যক প্রোটন থাকে, সেই সংখ্যাকে ঐ মৌলের পারমাণবিক সংখ্যা বলে।
নিউক্লিয়ন সংখ্যা হচ্ছে প্রোটন ও নিউট্রন সংখ্যার যোগফল। সুতরাং নিউট্রন সংখ্যা = নিউক্লিয়ন সংখ্যা বা ভরসংখ্যা (অ) প্রোটন সংখ্যা বা পারমাণবিক সংখ্যা (ত) এর নিউট্রন সংখ্যা = ৬৪ -২৯ = ৩৫
এর নিউট্রন সংখ্যা = ৬৪ – ৩০ = ৩৪
এখানে, এবং
মৌল দুটির প্রোটন সংখ্যা বা পারমাণবিক সংখ্যা যথাক্রমে ২৯, ৩০ এবং নিউক্লিয়ন সংখ্যা বা ভরসংখ্যা যথাক্রমে ৬৪, ৬৪; অর্থাৎ, মৌল দুটির পারমাণবিক সংখ্যা বা প্রোটন সংখ্যা ভিন্ন। তাই নিউক্লিয়ন সংখ্যা সমান হলেও, নিউট্রন সংখ্যা ভিন্ন হবে।
ফরিদের আঁকা মডেলটি রাদারফোর্ড পরমাণু মডেলকে সমর্থন করে। নিম্নে রাদারফোর্ডের পরমাণু মডেলটি সম্পর্কে স্পষ্ট ধারণা পাওয়া যায়। নিচে মডেলটি ব্যাখ্যা করা হলো :
১. পরমাণুর কেন্দ্রস্থলে একটি ধনাত্মক চার্জবিশিষ্ট ভারি বস্তু বিদ্যমান। এই ভারি বস্তুকে পরমাণুর কেন্দ্র বা নিউক্লিয়াস বলা হয়। পরমাণুর মোট আয়তনের তুলনায় নিউক্লিয়াসের আয়তন অতি নগণ্য। নিউক্লিয়াসে পরমাণুর সমস্ত ধনাত্মক চার্জ ও প্রায় সমস্ত ভর কেন্দ্রীভ‚ত।
২. পরমাণু বিদ্যুৎনিরপেক্ষ। অতএব নিউক্লিয়াসের ধনাত্মক চার্জযুক্ত প্রোটন সংখ্যার সমান সংখ্যক ঋণাত্মক চার্জযুক্ত ইলেকট্রন পরমাণুর নিউক্লিয়াসকে পরিবেষ্টন করে রাখে।
৩. সৌরজগতের সূর্যের চারদিকে ঘূর্ণায়মান গ্রহসমূহের মতো পরমাণুর ইলেকট্রনগুলো নিউক্লিয়াসের চারদিকে অবিরাম ঘুরছে। ধনাত্মক চার্জবিশিষ্ট নিউক্লিয়াস ও ঋণাত্মক চার্জবিশিষ্ট ইলেকট্রনসমূহের পারস্পরিক স্থির বৈদ্যুতিক আকর্ষণজনিত কেন্দ্রমুখী বল এবং ঘূর্ণায়মান ইলেকট্রনের কেন্দ্র বহির্মুখী বল পরস্পর সমান।
উদ্দীপকে বিদ্যমান অঙ্কিত মডেল বিশ্লেষণ করলে দেখা যায়, ইলেকট্রনগুলো সর্পিলাকারে ঘুরতে ঘুরতে নিউক্লিয়াসে পতিত হচ্ছে, তাই অঙ্কিত মডেলটি একটি অস্থায়ী পরমাণু মডেল।
‘গ’ থেকে জানা যায়, অঙ্কিত মডেলটি রাদারফোর্ডের পরমাণু মডেলকে সমর্থন করে। এই মডেলের ৩য় স্বীকার্য অনুযায়ী ইলেকট্রনগুলো নিউক্লিয়াসের চারদিকে ঘোরে। এ সময় ধনাত্মক চার্জবিশিষ্ট নিউক্লিয়াস ও ঋণাত্মক চার্জবিশিষ্ট ইলেকট্রনসমূহের পারস্পরিক স্থির বৈদ্যুতিক আকর্ষণজনিত কেন্দ্রমুখী বল এবং ঘূর্ণায়মান ইলেকট্রনের কেন্দ্র বহির্মুখী বল পরস্পর সমান থাকে। তাই এটি স্থায়িত্ব লাভ করবে। কিন্তু, ম্যাক্সওয়েলের মতবাদ অনুসারে এই পরমাণু মডেলটির স্থায়ীত্ব লাভ করা সম্ভব নয়। কারণ, কোনো চার্জযুক্ত বস্তু বা কণা কোনো বৃত্তাকার পথে ঘুরতে থাকলে তা ক্রমাগত শক্তি বিকিরণ করবে এবং আবর্তন চক্রও ধীরে ধীরে কমতে থাকবে। যেহেতু ইলেকট্রন ঋণাত্মক চার্জযুক্ত, তাই ইলেকট্রনসমূহ ক্রমশ শক্তি হারাতে হারাতে নিউক্লিয়াসে প্রবেশ করবে।
অর্থাৎ, অঙ্কিত পরমাণু মডেল অনুসারে পরমাণু সম্পূর্ণভাবে একটি অস্থায়ী অবস্থাপ্রাপ্ত হবে।
প্রশ্ন -২ : নিচের ছকটি লক্ষ কর এবং প্রশ্নগুলোর উত্তর দাও :
| 4W | 12X | 20Y | 29Z |
[এখানে W, X, Y এবং Z প্রতীকী অর্থে; প্রচলিত কোনো মৌলের প্রতীক নয়]
ক. ভরসংখ্যা কী?
খ. 3Li ও 11Na এর যোজনী একই কেন ব্যাখ্যা কর।
গ. উদ্দীপকের কোন কোন মৌলের সর্বশেষ স্তরে সমানসংখ্যক ইলেকট্রন বিদ্যমান?
ঘ. উপরের একটি মৌলের ইলেকট্রন বিন্যাস স্বাভাবিক নিয়মে করা যায় না যুক্তিসহ উপস্থাপন কর।
ভরসংখ্যা হলো কোনো মৌলের পরমাণুর প্রোটন ও নিউট্রনের মোট সংখ্যা।
যোজনী হলো কোনো মৌলের সর্ববহিস্থ শক্তিস্তরে বিদ্যমান ইলেকট্রন সংখ্যা।
3Li ও 11Na এর ইলেকট্রন বিন্যাস নিম্নরূপ :
3Li®1s22s1
11Na®1s2 2s2 2p6 3s1
যেহেতু লিথিয়াম (খর) ও সোডিয়াম (ঘধ) উভয় মৌলের সর্ববহিস্থ স্তরে একটি করে ইলেকট্রন বিদ্যমান। তাই, এদের যোজনী একই এবং তা হলো ১।
উদ্দীপকে প্রদত্ত মৌলগুলোর ইলেকট্রন বিন্যাস নিম্নরূপ :
মৌলের ইলেকট্রন বিন্যাস সর্বশেষ কক্ষপথে ইলেকট্রনের সংখ্যা
| মৌলের প্রতীক | মৌলের ইলেকট্রন বিন্যাস | সর্বশেষ কক্ষপথে ইলেকট্রনের সংখ্যা |
| 4W | 1s2 2s2 | 2 |
| 12X | 1s2 2s2 2p6 3s2 | 2 |
| 20Y | 1s2 2s2 2p6 3s23p6 4s2 | 2 |
| 29Z | 1s2 2s2 2p6 3s2 3p6 3d104s1 | 1 |
দেখা যাচ্ছে যে, প্রদত্ত মৌলগুলোর মধ্যে 29Z বাদে বাকি তিনটির অর্থাৎ 4W, 12X, 20Y মৌলসমূহের সর্বশেষ স্তরে সমান সংখ্যক ইলেকট্রন বিদ্যমান।
উদ্দীপকের একটি মৌলের ইলেকট্রন বিন্যাস স্বাভাবিক নিয়মে করা যায় না এবং সেটি হলো 29Z।
সাধারণ নিয়ম অনুসারে পরমাণুতে ইলেকট্রন শক্তির ক্রমানুসারে নিম্ন থেকে উচ্চ শক্তিসম্পন্ন অরবিটালে প্রবেশ করে। সাধারণ নিয়ম অনুসারে নিম্ন শক্তিস্তর বা উপশক্তিস্তর ইলেকট্রন দ্বারা পূর্ণ হলে পরবর্তী শক্তিস্তরে বা উপশক্তিস্তরে ইলেকট্রন প্রবেশ করে। অর্থাৎs পূর্ণ হলে p, d পূর্ণ হলে ফ এভাবে বিভিন্ন কক্ষপথে ইলেকট্রন বণ্টিত হয়। কাজেই, 29Z এর ইলেকট্রন বিন্যাস হওয়া উচিত ছিল : 1s22s22p63s23p63d94s2
প্রকৃতপক্ষে 29Zএর ইলেকট্রন বিন্যাস: 1s2 2s22p63s23p63d104s1
ইলেকট্রন বিন্যাসের সাধারণ নিয়ম অনুযায়ী Z এর 4s অরবিটালে ২টি এবং 3d অরবিটালে ৯টি ইলেকট্রন থাকার কথা। কিন্তু সেক্ষেত্রে 3d অরবিটাল ১টি মাত্র ইলেকট্রনের অভাবে অপূর্ণ থেকে যায়। কিন্তু সমশক্তি সম্পন্ন অরবিটালসমূহ অর্ধপূর্ণ বা সম্পূর্ণরূপে পূর্ণ হলে সেই ইলেকট্রন বিন্যাস অধিকতর সুস্থিতি অর্জন করে। কাজেই d9 কাঠামোর চেয়ে d10 কাঠামো অনেক বেশি সুস্থিত। ফলে d9s2 এর চেয়ে d10s1 ইলেকট্রনবিশিষ্ট মৌল অধিকতর স্থায়ী হয়। তাই ত এর ক্ষেত্রে স্থিতিশীলতা অর্জনের জন্য 4s থেকে ১টি ইলেকট্রন 3d তে গিয়ে একটি সুস্থিত কাঠামোর সৃষ্টি হয়। অতএব যৌক্তিক কারণেই 29Z মৌলটির ইলেকট্রন বিন্যাস স্বাভাবিক নিয়মে করা যায় না।
প্রশ্ন -৩ : নিচের উদ্দীপকটি পড় এবং প্রশ্নগুলোর উত্তর দাও :
26A, 29B
[এখানে A ও B প্রতীকী অর্থে, প্রচলিত কোনো মৌলের প্রতীক নয়।]
ক. সমাণু কী? ১
খ. উদাহরণসহ আইসোটোপের সংজ্ঞা দাও। ২
গ. উদ্দীপকে দ্বিতীয় মৌলটির ইলেকট্রনবিন্যাস ব্যতিক্রমÑব্যাখ্যা কর। ৩
ঘ. প্রথম মৌলটির ইলেকট্রনবিন্যাস লিখে এর যোজনীর ব্যাখ্যা দাও। ৪
একই আণবিক সংকেতবিশিষ্ট দুটি যৌগের ধর্ম ভিন্ন হলে তাদেরকে পরস্পরের সমাণু (ওংড়সবৎ) বলে।
বিভিন্ন ভরসংখ্যাবিশিষ্ট একই মৌলের পরমাণুকে পরস্পরের আইসোটোপ বলে। যেমনÑ ক্লোরিনের দুটি আইসোটোপ হলো যথাক্রমে 35/17 Cl এবং 37/17 Cl । নিউট্রন সংখ্যার ভিন্নতার কারণে আইসোটোপ তৈরি হয়। কারণ একই মৌলের পরমাণুর প্রোটন বা ইলেকট্রনের সংখ্যা কখনো পরিবর্তন হয় না।
উদ্দীপকের ২য় মৌলটি হলো 29B। এটি মূলত ২৯ পারমাণবিক সংখ্যাবিশিষ্ট মৌল কপার (Cu)।
বোরের পরমাণু মডেল থেকে আমরা জানি যে, পরমাণুর ইলেকট্রনসমূহ তাদের নিজ নিজ শক্তি অনুযায়ী বিভিন্ন শক্তিস্তরে অবস্থান করে। ইলেকট্রন বিন্যাসের সময় নিম্ন শক্তিস্তর ইলেকট্রন দ্বারা পূর্ণ হলে পরবর্তী শক্তিস্তরে ইলেকট্রন প্রবেশ করে। প্রতিটি প্রধান শক্তিস্তর (ড়ৎনরঃ) আবার এক বা একাধিক উপশক্তি স্তর (ড়ৎনরঃধষ) নিয়ে গঠিত। এ উপস্তরগুলোকে s, p, d f ইত্যাদি নামে আখ্যায়িত করা হয়।s উপশক্তিস্তরে সর্বোচ্চ ইলেকট্রন ধারণক্ষমতা ২, pউপস্তরের ৬, d উপস্তরের ১০ এবং f উপস্তরের ১৪। ইলেকট্রন সমূহের সাধারণ ধর্ম হচ্ছে এরা প্রথমে নিম্নতর শক্তি সম্পন্ন উপস্তর পূর্ণ করে এবং ক্রমান্বয়ে উচ্চ শক্তিসম্পন্ন উপস্তরে গমন করে। এই তত্ত¡ অনুসারে 4s উপস্তরে ইলেকট্রন 3d এর পূর্বে প্রবেশ করে।
তবে সাধারণভাবে দেখা যায় যে, সমশক্তিসম্পন্ন অরবিটালসমূহ অর্ধ বা সম্পূর্ণরূপে পূর্ণ হলে সে ইলেকট্রন বিন্যাস অধিকতর সুস্থিতি অর্জন করে। এজন্য d10s2 এবং d5s1 ইলেকট্রন বিন্যাসবিশিষ্ট মৌল অধিকতর স্থায়ী হয়। কপারের ক্ষেত্রে ইলেকট্্রন বিন্যাসের এরূপ ব্যতিক্রম পরিলক্ষিত হয়Ñ
Cu(২৯) ® 1s22s22p6 3s23 p6 3d10 4s1
উদ্দীপকে উল্লেখিত প্রথম মৌলটি হলো 26A যা হলো ২৬ পারমাণবিক সংখ্যাবিশিষ্ট মৌল Fe। আয়রন (Fe) এর ইলেকট্রন বিন্যাস নিম্নরূপÑ
Fe(২৬) ® 1s2 2s22p6 3s23p6 3d6 4s2( সাধারণ অবস্থায়)
কোনো মৌলের পরমাণুর ইলেকট্রন বিন্যাসে সর্বশেষ কক্ষপথে যত সংখ্যক ইলেকট্রন বা অযুগ্ম ইলেকট্রন থাকে তাকে ঐ মৌলের যোজনী বলে। ধাতব মৌলের ক্ষেত্রে সর্বশেষে কক্ষপথের ইলেকট্রন সংখ্যা এবং অধাতব মৌলের ক্ষেত্রে সর্বশেষ কক্ষপথের উপস্তরসমূহের মধ্যে ইলেকট্রন পুনর্বিন্যাসের কারণে অযুগ্ম ইলেকট্রন সংখ্যা পরিবর্তিত হয়। যার দরুন মৌলসমূহ পরিবর্তনশীল যোজ্যতা বা একাধিক যোজ্যতা প্রদর্শন করে। তাই, সাধারণ অবস্থায় আয়রনের যোজনী হয় ২।
আবার, উত্তেজিত অবস্থায় আয়রনের (Fe) ইলেকট্রন বিন্যাস নিম্নরূপÑ
Fe* (২৬) 1s2 2s22p6 2s23p6 3d54s24px1 4py° 4pz°
‘*’ চিহ্ন দ্বারা মৌলের উত্তেজিত অবস্থা প্রকাশ করে। এ অবস্থায় মৌলের যোজ্যতাস্তরের ফাঁকা উপস্তরে ইলেকট্রন পুনর্বিন্যস্ত হয়। ঢ় উপস্তরের সংখ্যা ৩টি (ঢ়ী, ঢ়ু, ঢ়ু) থাকে। ঢ় উপস্তরের ইলেকট্রন ধারণক্ষমতা ছয়টি। প্রতিটি ঢ় উপস্তরে ২ টি করে ইলেকট্রন থাকতে পারে। তবে, প্রথমে ঢ় উপস্তরসমূহের প্রত্যেকটিতে একটি করে ইলেকট্রন প্রবেশ করে। এজন্য উত্তেজিত অবস্থায় আয়রনের যোজনী হয় ‘৩’।
রসায়ন তৃতীয় অধ্যায় পদার্থের গঠন সৃজনশীল প্রশ্ন ও উত্তর
প্রশ্ন -৪ : নিচের উদ্দীপকটি পড় এবং প্রশ্নগুলোর উত্তর দাও :
নবম শ্রেণির রসায়ন শিক্ষক অভিজিৎ রায় তার শিক্ষার্থীদেরকে পরমাণুর গঠন সম্পর্কে বোঝানোর সময় একটি পরমাণুর সৌর মডেলের প্রস্তাবনা সম্পর্কে বোঝাচ্ছিলেন। অতঃপর, তিনি শিক্ষার্থীদেরকে উক্ত মডেলের প্রস্তাবনাগুলোর সীমাবদ্ধতা নিজেদের মধ্যে আলোচনার মাধ্যমে খুঁজে বের করতে বললেন।
ক. নিউক্লিয় বিক্রিয়ার ক্ষতিকর প্রভাব কী? ১
খ. তেজস্ক্রিয় রশ্মি সূর্যের আলোর ন্যায় নিরাপদ কখন? ২
গ. উদ্দীপকের শিক্ষক কর্তৃক বর্ণিত পরমাণু মডেলটির প্রস্তাবনাগুলো তুলে ধর। ৩
অতিরিক্ত তেজস্ক্রিয় রশ্মির ব্যবহার স্বাস্থ্যের জন্য মারাত্মক ক্ষতিকর খাদ্যদ্রব্যে ব্যবহারের ক্ষেত্রে তেজস্ক্রিয় রশ্মি অবশ্যই পরিমিত মাত্রায় সংরক্ষিত স্থানে প্রয়োগ করতে হবে। পরিমিত মাত্রায় এ তেজস্ক্রিয় রশ্মি (গামা রশ্মি)-র ব্যবহার সূর্যের আলোর ন্যায় নিরাপদ।
i. পরমাণুর কেন্দ্রস্থলে একটি ধনাত্মক চার্জবিশিষ্ট ভারী বস্তু বিদ্যমান। এই ভারী বস্তুকে পরমাণুর কেন্দ্র বা নিউক্লিয়াস বলা হয়। পরমাণুর মোট আয়তনের তুলনায় নিউক্লিয়াসের আয়তন অতি নগণ্য। নিউক্লিয়াসে পরমাণুর সমস্ত ধনাত্মক আধান ও প্রায় সমস্ত ভর কেন্দ্রীভ‚ত।
ii. পরমাণু বিদ্যুৎনিরপেক্ষ। অতএব নিউক্লিয়াসের ধনাত্মক আধানযুক্ত প্রোটন সংখ্যার সমান সংখ্যক ঋনাত্মক আধানযুক্ত ইলেকট্রন পরমাণুর নিউক্লিয়াসকে পরিবেষ্টন করে রাখে।
iii. সৌরজগতের সূর্যের চারিদিকে ঘূর্ণায়মান গ্রহসমূহের মতো পরমাণুর ইলেকট্রনগুলো নিউক্লিয়াসের চারিদিক অবিরাম ঘুরছে। ধনাত্মক আধান বিশিষ্ট নিউক্লিয়াস ও ঋনাত্মক আধান বিশিষ্ট ইলেকট্রনসমূহের পারস্পারিক স্থির বৈদ্যুতিক আকর্ষণজনিত কেন্দ্রমুখী বল এবং ঘূর্ণায়মান ইলেকট্রনের কেন্দ্র বর্হিমুখী বল পরপর সমান।
i. সৌরমন্ডলের গ্রহসমূহ সামগ্রিকভাবে চার্জবিহীন অথচ ইলেকট্রনসমূহ ঋণাত্মক চার্জযুক্ত।
ii. ম্যাক্সওয়েলের তত্ত¡ানুসারে কোনো চার্জযুক্ত বস্তু বা কণা বৃত্তাকার কক্ষপথে ঘুরতে থাকলে তা ক্রমাগত শক্তি বিকিরণ করবে এবং আবর্তনচক্রও ধীরে ধীরে ছোট হতে থাকবে। সুতরাং, ইলেকট্রনসমূহ ক্রমশ শক্তি হারাতে হারাতে নিউক্লিয়াসে প্রবেশ করবে। সুতরাং, রাদারফোর্ডের পরমাণু মডেল অনুসারে পরমাণু সম্পূর্ণভাবে একটি অস্থায়ী অবস্থা প্রাপ্ত হবে। অথচ পরমাণু হতে ক্রমাগত শক্তি বিকিরণ বা ইলেকট্রনের নিউক্লিয়াসে প্রবেশ কখনোই ঘটে না।
iii. পরমাণুর বর্ণালি গঠনের কোনো সুষ্ঠু ব্যাখ্যা এ মডেল দিতে পারে না।
iv. আবর্তনশীল ইলেকট্রনের কক্ষপথের আকার ও আকৃতি সম্বন্ধে কোনো ধারণা এ মডেলে দেওয়া হয় নি।
v. একাধিক ইলেকট্রনবিশিষ্ট পরমাণুতে ইলেকট্রনগুলো নিউক্লিয়াসকে কীভাবে পরিভ্রমণ করে তার কোনো উল্লেখ এ মডেলে নেই।
প্রশ্ন -৫ : নিচের উদ্দীপকটি পড় এবং প্রশ্নগুলোর উত্তর দাও :
ডা. অমিত একজন ক্যানসার বিশেষজ্ঞ। বিভিন্ন তেজস্ক্রিয় আইসোটোপ ব্যবহার করে তিনি রোগ নির্ণয় ও নিরাময় করেন। এসকল কাজে তিনি α, β এবং γ রশ্মি ব্যবহার করেন। তবে এ ধরনের রশ্মির ব্যবহারে কিছু ক্ষতিকর প্রভাবও রয়েছে।
ক. শক্তিস্তর কী? ১
খ. অক্সিজেনের আপেক্ষিক আণবিক ভর কীভাবে জানা যায়? ২
গ. উদ্দীপকের শেষোক্ত উক্তিটির যথার্থতা ব্যাখ্যা কর। ৩
ঘ. কৃষিক্ষেত্রে ও বিদ্যুৎ উৎপাদনে আইসোটোপগুলোর গুরুত্ব আলোচনা কর। ৪
কোনো মৌলের পরমাণুর নিউক্লিয়াসের চারিদিকে ইলেকট্রনসমূহের আবর্তনের জন্য বৃত্তাকার কক্ষপথকে শক্তিস্তর বা অরবিট বলে।
একটি অক্সিজেন অণু অক্সিজেনের ২টি পরমাণু নিয়ে গঠিত। অক্সিজেনের আপেক্ষিক পারমাণবিক ভর হলো ১৬ এবং অক্সিজেনের একটি অণু-তে পরমাণুর সংখ্যা হলো ২টি। সুতরাং,
অক্সিজেনের (O2) আপেক্ষিক আণবিক ভর = ১৬ × ২ = ৩২ g.
তেজস্ক্রিয় পদার্থ থেকে বিভিন্ন ধরনের রশ্মি নির্গত হয়। এই পদার্থসমূহের কোনোটির সময়কাল বেশি আবার কোনোটির কম। এসকল তেজস্ক্রিয় রশ্মি (α, β এবং γ) ক্যানসার হওয়ার একটি বিশেষ কারণ। সঠিক মাত্রায় ব্যবহার না করলে এসকল রশ্মি কল্যাণকর না হয়ে অকল্যাণকর হয়ে দাঁড়ায়।
ক্যান্সার রোগের চিকিৎসায় কেমোথেরাপিতে তেজস্ক্রিয় পদার্থ ব্যবহার করা হয়। কেমোথেরাপির ফলে মাথার চুল পড়ে যায়, বমি বমি ভাব হয়। অনেক ক্ষেত্রে এসকল রশ্মি আমাদের জন্য প্রয়োজনীয় ব্যাকটেরিয়াকেও মেরে ফেলে।
তাছাড়া, নিউক্লিয়ার বিক্রিয়া হতে প্রাপ্ত নিউক্লিয় শক্তি যেমন বিদ্যুৎ উৎপাদনে ব্যবহৃত হয় তেমনি ধ্বংসাত্মক কাজেও ব্যবহার করা হয়। হিরোসিমা ও নাগাসাকিতে নিক্ষিপ্ত পারমাণবিক বোমাসহ সকল ধরনের আগ্নেয়াস্ত্রের শক্তির উৎস হলো নিউক্লিয়ার বিক্রিয়া।
উদ্দীপকে উল্লেখিত তেজস্ক্রিয় রশ্মিগুলোর বহুবিধ ব্যবহার রয়েছে। তন্মধ্যে, কৃষিক্ষেত্রে ও বিদ্যুৎ উৎপাদনে তেজস্ক্রিয় আইসোটোপগুলোর ব্যবহার নিম্নে তুলে ধরা হলো :
কৃষিক্ষেত্রে তেজস্ক্রিয় রশ্মির ব্যবহার : তেজস্ক্রিয় রশ্মি ব্যবহার করে নতুন নতুন উন্নত মানের বীজ উদ্ভাবন করা হচ্ছে। যার দরুণ ফলনের মানের উন্নতি ও পরিমাণ বাড়ানো হচ্ছে। তেজস্ক্রিয় ৩২চ যুক্ত ফসফেট দ্রবণ উদ্ভিদের মূলধারায় সূচিত করা হয়। গাইগার কাউন্টার ব্যবহার করে পুরো উদ্ভিদে এর চলাচল চিিহ্নত করে ফসফরাস ব্যবহার করে বিজ্ঞানীরা কী কৌশলে (সবপযধহরংস) উদ্ভিদ বেড়ে উঠে তা জানতে পারেন।
বিদ্যুৎ উৎপাদনে তেজস্ক্রিয় রশ্মির ব্যবহার : আইসোটোপসমূহ ক্ষয়ের সময় বা নিউক্লিয়ার বিক্রিয়ায় সময় প্রচুর পরিমাণে তাপ উৎপন্ন করে। এই তাপশক্তিকে বিভিন্ন ডিভাইস ব্যবহার করে বিদ্যুৎশক্তিতে রূপান্তরিত করা হয়। পৃথিবীর বিভিন্ন দেশের পারমাণবিক চুল্লি থেকে নিউক্লিয়ার বিক্রিয়ার মাধ্যমে প্রচুর পরিমাণে বিদ্যুৎ উৎপাদন করা হয়।
সুতরাং, দেখা যাচ্ছে যে, তেজস্ক্রিয় রশ্মি ব্যবহারে কৃষিক্ষেত্রে এবং বিদ্যুৎ উৎপাদনে ব্যাপক সাফল্য অর্জন সম্ভব হয়েছে।
প্রশ্ন -৬ : নিচের উদ্দীপকটি পড় এবং প্রশ্নগুলোর উত্তর দাও :
| মৌল | পারমাণবিক ভর | পারমাণবিক সংখ্যা |
| P | 12 | 6 |
| Q | 14 | 6 |
| R | 40 | 20 |
ক. আয়রনের ইলেকট্রন বিন্যাস দেখাও। ১
খ. 99mTc এর ব্যবহার লিখ। ২
গ. উদ্দীপকের চ এবং ছ এর মধ্যে সম্পর্ক দেখাও। ৩
ঘ. বোরের পরমাণু মডেল অনুসারে জ মৌলটির ইলেকট্রন বিন্যাস পর্যালোচনা কর। ৪
আয়রনের ইলেকট্রন বিন্যাস নিম্নরূপÑ
Fe(২৬) ® 1s2 2s2 1p6 3s23p6 3d64s2
99mTc থেকে গামা (γ) রশ্মি নির্গত হয়। ভর সংখ্যার পরে ‘স’ দ্বারা আইসোটোপের মেটাস্টাবল (সবঃধংঃধনষব) অবস্থা প্রকাশ পায়। 99mTc থেকে গামা রশ্মি নির্গত হওয়ার পর 99Tc ভরবিশিষ্ট আইসোটোপ উৎপন্ন হয়। দেহের হাড় বেড়ে যাওয়া এবং কোথায়, কেন ব্যথা হচ্ছে তা নির্ণয়ের জন্য 99m Tc ইনজেকশন দিলে বেশ কিছু সময় পরে পর্দায় দেখা যায় হাড়ের কোথায় কী ধরনের সমস্যা আছে।
উদ্দীপকের ছকে উল্লেখিত p এবং q পরমাণুদ্বয়ের পারমাণবিক সংখ্যা একই কিন্তু পারমাণবিক ভর ভিন্ন। অর্থাৎ এদের ভরসংখ্যা ভিন্ন।
বিভিন্ন ভরসংখ্যাবিশিষ্ট একই মৌলের পরমাণুকে পরস্পরের আইসোটোপ বলা হয়। অর্থাৎ, একই মৌলের ভিন্ন ভিন্ন ভরসংখ্যা কিন্তু একই পারমাণবিক সংখ্যাবিশিষ্ট পরমাণুসমূহ হলো পরস্পরের আইসোটোপ। উদ্দীপকের চ এবং ছ উভয় মৌলদ্বয়ের পারমাণবিক সংখ্যা একই অর্থাৎ ৬ কিন্তু ভরসংখ্যা যথাক্রমে ১২ এবং ১৪। সুতরাং, উদ্দীপকের p ও q মৌলদ্বয় পরস্পরের আইসোটোপ।
ঘ.
উদ্দীপকের জ মৌলটি হলো ‘২০’ পারমাণবিক সংখ্যা এবং ‘৪০’ পারমাণবিক ভর বিশিষ্ট মৌল ক্যালসিয়াম (Ca)। বোরের পরমাণু মডেল অনুসারে মৌলটির ইলেকট্রন বিন্যাস নিম্নে আলোচনা করা হলো :
বোরের পরমাণু মডেল থেকে আমরা জেনেছি যে, পরমাণুর ইলেকট্রনসমূহ তাদের নিজ নিজ শক্তি অনুযায়ী বিভিন্ন শক্তিস্তরে অবস্থান করে। ক্যালসিয়ামের ইলেকট্রন বিন্যাস নিম্নরূপ :
মৌল পারমাণবিক সংখ্যা অরবিট বা প্রধান শক্তিস্তর ইলেকট্রন বিন্যাসের চিত্র
| মৌল | পারমাণবিক সংখ্যা | অরবিট বা প্রধান শক্তিস্তর | ইলেকট্রন বিন্যাসের চিত্র | |||
| K | L | M | N | |||
| Ca | 20 | 2 | 8 | 8 | 2 | 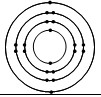 |
2n2 সূত্রানুসারে, ক্যালসিয়ামের M শেলে ১০টি ইলেকট্রন থাকার কথা থাকলেও এটি সাধারণত ৪টি ইলেকট্রন ধারণ করে। ইলেকট্রনসমূহের সাধারণ ধর্ম হচ্ছে এরা প্রথমে নিম্ন শক্তি সম্পন্ন উপস্তর (ড়ৎনরঃ) পূর্ণ করে এবং ক্রমান্বয়ে উচ্চ শক্তিসম্পন্ন উপস্তরে গমন করে। এজন্য ক্যালসিয়ামের (Ca) ইলেকট্রন বিন্যাস এরূপ হয়।
রসায়ন তৃতীয় অধ্যায় পদার্থের গঠন আরো কিছু সৃজনশীল প্রশ্ন উত্তর
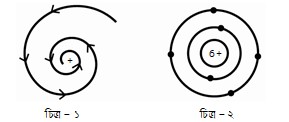
প্রশ্ন -৭ : নিচের চিত্র দুটি লক্ষ কর এবং প্রশ্নগুলোর উত্তর দাও :
ক. নিউক্লিয়ন সংখ্যা কী? ১
খ. তেজস্ক্রিয় আইসোটোপের দুইটি ক্ষতিকর প্রভাব লিখ। ২
গ. চিত্র-১ এ প্রদর্শিত পরমাণু মডেলের মূল বক্তব্যগুলি বর্ণনা কর। ৩
ঘ. চিত্র-১ অপেক্ষা চিত্র-২ পরমাণুতে ইলেকট্রনের অবস্থান সম্পর্কিত ধারণাকে অধিকতর গ্রহণযোগ্য করেছেÑ যুক্তি দাও। ৪
নিউক্লিয়ন সংখ্যা হলো মৌলে পরমাণুর কেন্দ্রে নিউক্লিয়াসে অবস্থানকারী প্রোটন ও নিউট্রন সংখ্যার সমষ্টি।
তেজষ্ক্রিয় আইসোটোপের দুইটি ক্ষতিকর প্রভাব নিম্নে দেওয়া হলো :
i. তেজস্ক্রিয় আইসোটোপকে ক্যান্সার রোগের অন্যতম কারণ হিসেবে বিবেচনা করা হয়,
ii. পারমাণবিক অস্ত্র তৈরিতে ব্যবহৃত হয় যা অসংখ্য মানুষের প্রাণহানি ঘটায়।
চিত্র-১ এ প্রদর্শিত পরমাণু মডেলটি হলো রাদারফোর্ডের পরমাণু মডেল যা ১৯১১ সালে প্রকাশিত হয়েছে। একে পরমাণুর সৌর মডেলও বলা হয়।
নিচে চিত্র-১ এ প্রদর্শিত রাদারফোর্ডের পরমাণু মডেলের মূল বক্তব্যগুলো বর্ণনা করা হলো :
১. পরমাণুর কেন্দ্রস্থলে একটি ধনাত্মক চার্জবিশিষ্ট ভারী বস্তু বিদ্যমান। এই ভারী বস্তুকে পরমাণুর কেন্দ্র বা নিউক্লিয়াস বলা হয়। পরমাণুর মোট আয়তনের তুলনায় নিউক্লিয়াসের আয়তন অতি নগণ্য। নিউক্লিয়াসে পরমাণুর সমস্ত ধনাত্মক চার্জ ও প্রায় সমস্ত ভর কেন্দ্রীভ‚ত।
২. পরমাণু বিদ্যুৎনিরপেক্ষ। অতএব নিউক্লিয়াসের ধনাত্মক চার্জযুক্ত প্রোটন সংখ্যার সমান সংখ্যক ঋণাত্মক চার্জযুক্ত ইলেকট্রন পরমাণুর নিউক্লিয়াসকে পরিবেষ্টন করে রাখে।
৩. সৌরজগতের সূর্যের চারদিকে ঘূর্ণায়মান গ্রহসমূহের মতো পরমাণুর ইলেকট্রনগুলো নিউক্লিয়াসের চারদিকে অবিরাম ঘুরছে। ধনাত্মক চার্জবিশিষ্ট নিউক্লিয়াস ও ঋণাত্মক চার্জবিশিষ্ট ইলেকট্রনসমূহের পারস্পরিক স্থির বৈদ্যুতিক আকষর্ণজনিত কেন্দ্রমুখী বল এবং ঘূর্ণায়মান ইলেকট্রনের কেন্দ্র বহির্মুখী বল পরস্পর সমান।
চিত্র-১ অপেক্ষা চিত্র-২ পরমাণুতে ইলেকট্রনের অবস্থান সম্পর্কিত ধারণাকে অধিকতর গ্রহণযোগ্য করেছে।
উদ্দীপকের ১নং চিত্রের মডেলটি ধনাত্মক নিউক্লিয়াস এবং তার চারপাশে ঘূর্ণনরত ঋণাত্মক ইলেকট্রন সম্পর্কে ধারণা দিচ্ছে। অপরদিকে ২নং চিত্রের মডেল অনুমোদিত কক্ষপথের ধারণা দেয়ার মাধ্যমে নিউক্লিয়াসের বাইরে ইলেকট্রন বিচরণের নির্দিষ্ট স্থান উল্লেখ করেছে। অর্থাৎ ১নং চিত্র মূলত রাদারফোর্ডের পরমাণু মডেল এবং ২নং চিত্র মূলত নীলস বোরের পরমাণু মডেল। নিচে চিত্র দুটির তুলনামূলক আলোচনা থেকে ইলেকট্রনের অবস্থান সম্পর্কিত ধারণার গ্রহণযোগ্যতা নির্ণয় করা হলো :
১. রাদারফোর্ড এর মডেল ধারণা দেয় পরমাণুর কেন্দ্রে অবস্থিত ধনাত্মক নিউক্লিয়াস এবং তার চারপাশে থাকা ঋণাত্মক ইলেকট্রন এর অস্তিত্ব সম্পর্কে। কিন্তু আবর্তনশীল ইলেকট্রন এর কক্ষপথের আকার ও আকৃতি সম্পর্কে কোনো ধারণা দেয় না। অন্যদিকে বোর মডেল কিছু অনুমোদিত স্থায়ী কক্ষপথের ধারণা দেয় যাতে ইলেকট্রনসমূহ কোনোরূপ শক্তি বিকিরণ না করে অনবরত ঘুরতে থাকে। এই কক্ষপথগুলোকে শক্তিস্তর বলে। চিত্র-২ এ বিভিন্ন শক্তিস্তরে অবস্থিত ইলেকট্রন দেখানো হয়েছে।
২. ১নং চিত্রের মডেল একটিমাত্র ইলেকট্রন বিশিষ্ট পরমাণুর আকৃতি সম্পর্কে ধারণা দেয় কিন্তু একাধিক ইলেকট্রন বিশিষ্ট পরমাণুতে ইলেকট্রনগুলো কীভাবে নিউক্লিয়াসকে পরিক্রমণ করবে তার কোনো ধারণা পাওয়া যায় না। কিন্তু ২নং চিত্রের মডেল একাধিক ইলেকট্রনবিশিষ্ট পরমাণুর আকৃতি ও অবস্থান সম্পর্কে ধারণা দেয়।
৩. ১নং চিত্রের মডেলটি পরমাণুতে ইলেট্রনের ঘূর্ণনকে সৌরজগতের সাথে তুলনা করেছে যা একটি বড় ভুল। কারণ সৌরজগতের গ্রহগুলো চার্জ নিরপেক্ষ। তাছাড়া, ম্যাক্সওয়েলের তত্ত¡ানুসারে কোনো চার্জযুক্ত বস্তু বা কণা কোনো বৃত্তাকার পথে ঘুরতে থাকলে তা ক্রমাগত শক্তি বিকিরণ করবে এবং তার আবর্তনচক্রও ধীরে ধীরে কমতে থাকবে। সুতরাং ইলেকট্রনসমূহ ক্রমশ শক্তি হারাতে হারাতে নিউক্লিয়াসে প্রবেশ করবে। অর্থাৎ রাদারফোর্ডের পরমাণু মডেল অনুসারে পরমাণু সম্পূর্ণভাবে একটি অস্থায়ী অবস্থা প্রাপ্ত হবে। অথচ পরমাণু হতে ক্রমাগত শক্তি বিকিরণ বা ইলেকট্রনের নিউক্লিয়াসে প্রবেশ কখনই ঘটে না। মডেল ২ শক্তির বিকিরণ বিষয়ক মতবাদ উপস্থাপনের মাধ্যমে শক্তি শোষণ বা বর্জনে ইলেকট্রন এর নির্দিষ্ট কক্ষপথে বিচরণের ধারণাকে আরও স্পষ্ট করে।
প্রশ্ন -৮ : নিচের উদ্দীপকটি পড় এবং প্রশ্নগুলোর উত্তর দাও :
শ্রেণিকক্ষে শিক্ষক পরমাণুর মডেল আঁকতে বললেন। সুমন অ মডেলটি এবং সুমনা ই মডেলটি আঁকল।
ক. অরবিটাল কী? ১
খ. পটাসিয়ামের ১৯-তম ইলেকট্রনটি 3d অরবিটালে প্রবেশ না করে 4s অরবিটালে প্রবেশ করে কেন? ২
গ. উদ্দীপকের ই মডেলের আলোকে পরমাণুর ঢ ও ণ শক্তিস্তরের অরবিটালের সংখ্যা ও ধারণকৃত ইলেকট্রন সংখ্যা হিসাব কর। ৩
ঘ. উদ্দীপকের দুটি মডেলের তুলনামূলক অবস্থান তুলে ধর। ৪
অরবিটাল হলো পরমাণুতে নিউক্লিয়াসের চারপাশে বিদ্যমান অনুমোদিত বৃত্তাকার কক্ষপথ বা শক্তিস্তরের উপশক্তিস্তর।
3d অরবিটালের চেয়ে 4s অরবিটালের ইলেকট্রন ধারণক্ষমতা কম বলে পটাশিয়ামের ১৯ তম ইলেকট্রনটি 3d অরবিটালে প্রবেশ না করে 4s অরবিটালে প্রবেশ করে।
পটাসিয়ামের ইলেকট্রন বিন্যাসটি হলো:
K(19)®1s22s22p63s23p63d°4s1 দেখা যাচ্ছে যে 3d অরবিটাল পর্যন্ত ১৮টি ইলেকট্রন প্রবেশ করার পর ১৯ তম ইলেকট্রনটি 3d অরবিটালে প্রবেশ করার কথা থাকলেও তা না হয়ে 4s অরবিটালে প্রবেশ করেছে। কারণ, মৌলের পরমাণুতে ইলেকট্রনসমূহ বিভিন্ন শক্তিস্তরে ধারণক্ষমতা অনুসারে সজ্জিত হয়। যেহেতু 4s অরবিটালের শক্তি 3d অরবিটালের শক্তির চেয়ে কম, তাই পটাসিয়ামের সর্বশেষ ইলেকট্রনটি 3d অরবিটালে প্রবেশ না করে 4s অরবিটালে প্রবেশ করে।
উদ্দীপকের ই মডেলের আলোকে ঢ ও ণ হলো যথাক্রমে ২য় ও ৩য় শক্তিস্তর। অর্থাৎ হ = ২ এবং হ = ৩ বা যথাক্রমে খ ও গ শেল। নিচে খ ও গ শেলে অরবিটাল সংখ্যা ও ইলেকট্রন সংখ্যা হিসাব করা হলো :
| শক্তিস্তর | উপস্তর | ইলেকট্রন সংখ্যা | ইলেকট্রন বিন্যাস |
| L শেল | 2s 2p | 8 | 2s2 2p6 |
| M শেল | 3s 3p 3d | 18 | 3s2 3p6 3d10 |
ঘ.
উদ্দীপকের অ মডেলটি ধনাত্মক নিউক্লিয়াস এবং তার চারপাশে ঘূর্ণনরত ঋণাত্মক ইলেকট্রন সম্পর্কে ধারণা দিচ্ছে। অপরদিকে, মডেল ই অনুমোদিত কক্ষপথের ধারণা দেয়ার মাধ্যমে নিউক্লিয়াসের বাইরে ইলেকট্রন বিচরণের নির্দিষ্ট স্থান উল্লেখ করেছে। অর্থাৎ মডেল অ মূলত রাদারফোর্ডের পরমাণু মডেল এবং মডেল ই মূলত নীলস বোরের পরমাণু মডেলকে নির্দেশ করছে। নিম্নে মডেল দুটির তুলনামূলক আলোচনা করা হলোÑ
১. রাদারফোর্ড (অ) এর মডেল ধারণা দেয় পরমাণুর কেন্দ্রে অবস্থিত ধনাত্মক নিউক্লিয়াস এবং তার চারপাশে থাকা ঋণাত্মক ইলেকট্রন এর অস্তিত্ব সম্পর্কে কিন্তু আবর্তনশীল ইলেকট্রন এর কক্ষপথের আকার ও আকৃতি সম্পর্কে অ মডেলটি কোনো ধারণা দেয় না। অন্যদিকে বোর (ই) মডেল কিছু অনুমোদিত বা স্থায়ী কক্ষপথের ধারণা দেয় যাতে ইলেকট্রনসমূহ কোনোরূপ শক্তি বিকিরণ না করে অনবরত ঘুরতে থাকে। এই কক্ষপথগুলোকে শক্তিস্তর বলে। মডেল ই তে প্রদত্ত n = 1, ২, ৩ যথাক্রমে ক, খ, গ ইত্যাদি শক্তিস্তরকে বোঝায়।
২. অ মডেলটি একটিমাত্র ইলেকট্রন বিশিষ্ট পরমাণুর আকৃতি সম্পর্কে ধারণা দেয় যা মূলত হাইড্রোজেন। কিন্তু একাধিক ইলেকট্রন বিশিষ্ট পরমাণুতে ইলেকট্রনগুলো কীভাবে নিউক্লিয়াসকে পরিক্রমণ করবে তার কোনো ধারণা অ মডেলে পাওয়া যায় না। কিন্তু ই মডেলটি এ ত্রæটি দূর করে।
৩. অ মডেলটি পরমাণুতে ইলেকট্রনের ঘূর্ণনকে সৌরজগতের সাথে তুলনা করেছে যা একটি বড় ভুল। কারণ সৌরজগতের গ্রহগুলো চার্জ নিরপেক্ষ হলেও ইলেকট্রনসমূহ চার্জ নিরপেক্ষ নয়। এগুলো ঋণাত্মক চার্জবিশিষ্ট। মডেল ই, শক্তির বিকিরণ বিষয়ক মতবাদ উপস্থাপনের মাধ্যমে শক্তি শোষণ বা বর্জনে ইলেকট্রন এর নির্দিষ্ট কক্ষপথে বিচরণের ধারণাকে আরও স্পষ্ট করে।
প্রশ্ন -৯ : নিচের উদ্দীপকটি পড় এবং প্রশ্নগুলোর উত্তর দাও :
বোরন মৌলের দুটো আইসোটোপ রয়েছে : 10/5 B এবং 10/5 B । প্রথমটির পর্যাপ্ততার শতকরা পরিমাণ হলো ২০%।
ক. N শেলে কতটি ইলেকট্রন থাকতে পারে? ১
খ. পারমাণবিক সংখ্যাকে একটি পরমাণুর নিজস্ব সত্তা বলা হয় কেন? ২
গ. উদ্দীপকে প্রদত্ত আইসোটোপদ্বয়ে প্রোটন, নিউট্রন ও ইলেকট্রন সংখ্যাসহ এদের অবস্থান নির্দেশ কর। ৩
ঘ. উদ্দীপকের তথ্য থেকে বোরনের আপেক্ষিক পারমাণবিক ভর নির্ণয় কর। ৪
N শেলে ৩২টি ইলেকট্রন থাকতে পারে।
পারমাণবিক সংখ্যা একটি পরমাণুর তথা মৌলের পরিচয় বহন করে বলে একে পরমাণুর নিজস্ব সত্তা বলা হয়।
কোনো মৌলের রাসায়নিক ধর্ম ও অন্যান্য মৌলিক ধর্ম পারমাণবিক সংখ্যার ওপর নির্ভরশীল। মৌলের পারমাণবিক সংখ্যা পরিবর্তিত হলে মৌলের ভৌত ও রাসায়নিক ধর্ম পরিবর্তিত হয়। কারণ, দুটি ভিন্ন মৌলের পারমাণবিক সংখ্যা কখনোই এক হয় না। অর্থাৎ নির্দিষ্ট মৌলের পারমাণবিক সংখ্যা নির্দিষ্ট থাকায় ঐ মৌলের ধর্মও নির্দিষ্ট থাকে। এ কারণেই পারমাণবিক সংখ্যাই হলো পরমাণুর নিজস্ব সত্তা।
10/5 B সংকেত থেকে জানা যায়, 10/5 B এর ইলেকট্রন বিন্যাস = ২, ৩। পারমাণবিক সংখ্যা = ৫ এবং ভর সংখ্যা = ১০।
যেহেতু পারমাণবিক সংখ্যা = প্রোটন সংখ্যা = ইলেকট্রন সংখ্যা
আবার যেহেতু ভর সংখ্যা প্রোটন ও নিউট্রন সংখ্যার সমষ্টি, সুতরাং, নিউট্রন সংখ্যা = ভরসংখ্যা- প্রোটন সংখ্যা = (১০ – ৫) = ৫
অপরদিকে, 10/5 B এর পারমাণবিক সংখ্যা = প্রোটন সংখ্যা = ইলেকট্রন সংখ্যা = ৫, ভরসংখ্যা = ১১ এবং ইলেকট্রন বিন্যাস = ২, ৩।
যেহেতু নিউট্রন সংখ্যা = ভরসংখ্যা – প্রোটন সংখ্যা ;
সেহেতু 10/5 B এর নিউট্রন সংখ্যা = ১১ -৫ = ৬।
উদ্দীপকের তথ্যানুযায়ী, 10/5 B ও 10/5 B আইসোটোপ দুটির মধ্যে 10/5 B এর পরিমাণ হলো, ২০%।
অতএব, একটি বোরনের নমুনায়, 10/5 B রয়েছে ১০০ – ২০% = ৮০%।
নিচের ছকে বোরনের আপেক্ষিক পারমাণবিক ভর নির্ণয় করা হলো।
| আইসোটোপ | 10B | 11B |
| ভরসংখ্যা | 10 | 11 |
| শতকরা পরিমাণ | 20 | 80 |
| আপেক্ষিক পারমাণবিক ভর | (10 × 20 ÷100) + (11 × 80 ÷100) = 2 + 8.8 = 10.8 | |
সুতরাং, নির্ণেয় বোরনের আপেক্ষিক পারমাণবিক ভর ১০.৮।
প্রশ্ন -১০ : নিচের উদ্দীপকটি পড় এবং প্রশ্নগুলোর উত্তর দাও :
প্রকৃতিতে বহু ধরনের আইসোটোপ বিদ্যমান। এদের মধ্যে উল্লেখযোগ্য হচ্ছে ১৪ঈ,
14C, 99mTc, 131I, 153Sm, 89Sr, 60Co, 238Pu, 32P, 137Cs.
ক. তেজস্ক্রিয়তা কী? ১
খ. তেজস্ক্রিয় আইসোটোপ বলতে কী বোঝ? ২
গ. উদ্দীপকের আইসোটোপসমূহের মধ্যে কোন্ আইসোটোপ কোন রোগ, রোগাক্রান্ত স্থান নির্ণয়ে ও রোগের চিকিৎসায় ব্যবহৃত হয়? ব্যাখ্যা কর। ৩
ঘ. উদ্দীপকের কোন কোন আইসোটোপ মানুষের খাদ্য উন্নয়নে কাজে লাগে, আলোচনা কর। ৪
প্রশ্ন -১১ : নিচের উদ্দীপকটি পড় এবং প্রশ্নগুলোর উত্তর দাও :
নিম্নে কতিপয় প্রতীকী মৌল দেয়া হলো :
12X, 20Z, 23A, 26Y ক. আইসোটোপ কী? ১
খ. প্রধান শক্তিস্তরগুলোর সাথে সংশ্লিষ্ট উপশক্তিস্তরগুলোর সম্পর্ক দেখাও। ২
গ. উদ্দীপকের ঢ এর ইলেকট্রন বিন্যাসে প্রধান শক্তিস্তর উপশক্তিস্তরগুলোর শক্তিক্রম অনুসরণ করে ব্যাখ্যা কর। ৩
ঘ. প্রধান শক্তিস্তরের সকল উপস্তর পাশাপাশি লিখে উদ্দীপকের X, Z, A, Y মৌলগুলোর ইলেকট্রন বিন্যাস দেখাও। ৪
১১নং প্রশ্নের উত্তর
ক. একই মৌলের ভিন্ন ভিন্ন ভরসংখ্যাবিশিষ্ট পরমাণুসমূহকে পরস্পরের আইসোটোপ বলে।
খ. প্রধান শক্তিস্তরসমূহের সাথে সংশ্লিষ্ট উপশক্তিস্তরসমূহের সম্পর্ক K(n = 1) শক্তিস্তরের উপস্তরে সংখ্যা ১টি = 1s(১ হলো ১ম প্রধান শক্তিস্তর)। এর ইলেকট্রন ধারণ ক্ষমতা = ২টি।
L(n = 2) শক্তিস্তরের উপস্তর সংখ্যা = ২টি যা হলো 2s, 2p।
চ এর ইলেকট্রন ধারণক্ষমতা = ৬টি
M (n = 3 শক্তিস্তরের উপস্তর সংখ্যা ৩টি যা হলো 3s, 3p, 3d।
ফ এর ইলেকট্রন ধারণক্ষমতা = ১০টি।
N(n = 4) শক্তিস্তরের উপস্তর সংখ্যা ৪টি যা হলো 4s, 4p, 4d, 4f| । ভ এর ইলেকট্রন ধারণক্ষমতা =১৪টি।
গ. উদ্দীপকের X মৌলটির পারমাণবিক সংখ্যা ১২। এর ইলেকট্রন বিন্যাস ২, ৮, ২। ইলেকট্রনগুলো K, L ও M প্রধান শক্তিস্তরে থাকে। আবার আমরা জানি, পরমাণুর ইলেকট্রন বিন্যাসে ইলেকট্রনসমূহ বিভিন্ন অরবিটালে (উপশক্তিস্তরে) তাদের শক্তির নিম্নক্রম থেকে উচ্চক্রম অনুসারে প্রবেশ করে। স্থিতিশীলতা অর্জনের জন্য প্রথমে নিম্নশক্তির অরবিটালে ইলেকট্রন গমন করে এবং অরবিটাল পূর্ণ করে; এরপর ক্রমান্বয়ে উচ্চশক্তির অরবিটাল সমূহে ইলেকট্রন প্রবেশ করে। এভাবে প্রধান শক্তিস্তরের উপশক্তিস্তরগুলোর শক্তিক্রম নিম্নোক্ত ছকের মাধ্যমে জানা যায়।
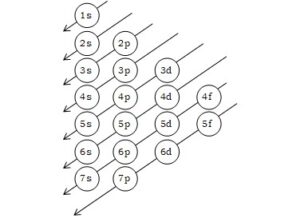
প্রদত্ত শক্তিক্রম অনুসারে X এর ইলেকট্রন বিন্যাস হবে 1s22s22p63s2|।
অতএব দেখা যাচ্ছে যে, উদ্দীপকের ঢ মৌলটির ইলেকট্রন বিন্যাসে প্রধান শক্তিস্তর উপশক্তিস্তরগুলোর শক্তিক্রম অনুসরণ করে।
ঘ. উদ্দীপকে প্রদত্ত মৌলগুলোর পারমাণবিক সংখ্যা থেকে জানা যায় যে, মৌলসমূহের ইলেকট্রন বিন্যাস নিম্নরূপ :
X(12) ® 2, 8, 2
Z(20) ® 2, 8, 8, 2
A(23) ® 2, 8, 8, 5
Y(26) ® 2, 8, 14, 2
এভাবে ইলেকট্রনগুলো প্রধান শক্তিস্তরে সজ্জিত থাকে। তবে বিভিন্ন উপশক্তিস্তরে বণ্টিত হয়।
উল্লেখ্য যে, প্রথম শক্তিস্তর K(n = 1) এর উপশক্তিস্তর একটি (১ং)। দ্বিতীয় শক্তিস্তর L(n = ২) এর উপশক্তিস্তর দুইটি (২ং ও ২ঢ়)। তৃতীয় শক্তিস্তর M(n = ৩) এর উপশক্তিস্তর তিনটি (3s, 3p ও 3d) এবং চতুর্থ শক্তিস্তর N(n = ৪) এর উপশক্তিস্তর চারটি (4s, 4p, 4d ও 4f)। তবে, নিম্নশক্তিস্তরে ইলেকট্রন পূর্ণ হয়ে গেলে উচ্চ শক্তিস্তরে ইলেকট্রন প্রবেশ করে না। ইলেকট্রন বিন্যাসের এ নিয়ম অনুসারে উদ্দীপকে প্রদত্ত X, Z, A ও Y মৌলগুলোর ইলেকট্রন বিন্যাস প্রধান শক্তিস্তরের সকল উপস্তর পাশাপাশি লিখে দেখানো হলো :
প্রশ্ন -১২ : নিচের উদ্দীপকটি পড় এবং প্রশ্নগুলোর উত্তর দাও :
কিছু মৌলের পারস্পরিক সংখ্যাসহ প্রতীক দেয়া হলো :
11A, 19Z, 24Y, 29X
ক. রাদারফোর্ডের পরমাণু মডেলের ভিত্তি কী ছিল? ১
খ. 4Be ও 12Mg এর যোজনী একই কেন? ব্যাখ্যা কর। ২
গ. উদ্দীপকের কোন কোন মৌলের রাসায়নিক ধর্মে মিল রয়েছে, ব্যাখ্যা কর। ৩
ঘ. উদ্দীপকের কোন কোন মৌলের ইলেকট্রন বিন্যাসের ক্ষেত্রে ভিন্নতা পরিলক্ষিত হয় যুক্তিসহ ব্যাখ্যা কর। ৪



Comments
Post a Comment
Thanks