টাইট্রেশন ও এসিড-ক্ষার মতবাদ
টাইট্রেশন (টাইট্রেমিতি এবং আয়তনিক বিশ্লেষণ) হল একটি পরিমাণগত রাসায়নিক বিশ্লেষণ পদ্ধতি যা জানা দ্রবণের ঘনমাত্রা (বিশ্লেষিত পদার্থের) দ্বারা অজানা দ্রবণের ঘনমাত্রা নির্ণয় করা হয়। এটি মূলত কোনো দ্রবনের অজানা ঘনমাত্রা নির্ণয়ের প্রক্রিয়া।
ট্রাইট্রেশনের জন্য প্রয়োজন একটি জানা ঘনমাত্রার দ্রবণ আর এই যানা ঘনমাত্রার দ্রবনকে বলা হয় স্টান্ডার সলিউশন।
সমতা বিন্দু(Equivalence point):সমতা বিন্দু(Equivalence point)হল ট্রাইট্রেশনের যে বিন্দুতে টাইট্রান্ট ও নমুনা দ্রবণের ঘনমাত্রা সমান হয় সেই বিন্দুকে সমতা বিন্দু(Equivalence point) বলে।
একটি এসিড একটি ক্ষারের সাথে বিক্রিয়া করলে এসিড থেকে প্রাপ্ত ঐ আয়ন এবং ক্ষার থেকে প্রাপ্ত ঐআয়ন মিলিত হয়ে পানি উৎপন্ন করে।
H+ + OH- → H2 O
এটিই প্রশমণ বিক্রিয়া। প্রশমণ বিক্রিয়ায় এসিড এবং ক্ষার বিক্রিয়া করে পানি ছাড়া আর যে বস্তুটি উৎপাদন করে তা হলো লবণ।
উদাহরণ ঃ
HCl + NaOH → H2 O + NaCl
(এসিড) (ক্ষার) (পানি) (লবণ)
একটি অজ্ঞাত ঘনমাত্রার এসিড দ্রবণের সাথে একটি জ্ঞাত ঘনমাত্রার ক্ষার দ্রবণের প্রশমণ বিক্রিয়া ঘটিয়ে এসিড
দ্রবণটির ঘনমাত্রা নির্ণয় করা যায়। একইভাবে একটি অজ্ঞাত ঘনমাত্রার ক্ষার দ্রবণের সাথে একটি জ্ঞাত ঘনমাত্রার এসিড দ্রবণের প্রশমণ বিক্রিয়া ঘটিয়ে ক্ষার দ্রবণটির ঘনমাত্রার নির্ণয় করা যায়। এ পদ্ধতিকে টাইট্রেশন বলা হয়।
টাইট্রেশনের জন্য পিপেটের সাহায্যে এসিড বা ক্ষার কোন একটি দ্রবণের একটি নির্দিষ্ট আয়তন (যেমন, ১০
মি.লি) একটি কোনিক্যাল ফ্লাস্কে নেয়া হয় এবং একটি বুরেট থেকে ধীরে ধীরে অন্য দ্রবণটিতে যোগ করা হয়।
বিক্রিয়ার শেষবিন্দু নির্ণয়ের জন্য কোনিক্যাল ফ্লাস্কের দ্রবণে প্রথমেই দু‘তিন ফোঁটা নির্দেশক দ্রবণ যোগ করা হয়। শেষ বিন্দুতে নির্দেশক তার রং পরিবর্তন করে প্রশমণ বিক্রিয়ার সমাপ্তি নির্দেশ করে।
এসিড A এবং ক্ষার B এর মধ্যে সংঘটিত প্রশমণ বিক্রিয়াটির সমীকরণ
xA + yB → → লবণ + পানি
'এসিড-ক্ষার টাইট্রেশনের মূলতত্ত্ব।
aA+bB=Product(উৎপাদ=লবণ+পানি)
a=এসিডের মোল সংখ্যা
SA= এসিডের ঘনমাত্রা
VA= এসিডের আয়তন
b=ক্ষারকের মোল সংখ্যা
SB= ক্ষারকের ঘনমাত্রা
VB= ক্ষারকের আয়তন
ব্যাক টাইট্রেশন:
আরহেনিয়াস মতবাদ:
আরেহেরিয়াস মতবাদ অনুসারে অম্ল-ক্ষরককে নিম্নরূপ সংজ্ঞায়িত করা হয়:
অম্ল বা এসিড: হাইড্রোজেন পরমানু যুক্ত যে সকল যৌগ জলীয় দ্রবণে প্রোটন (H+) দান করে তাকে অম্ল বা
এসিড বলে। যেমন HCl, H2SO4, HNO3 ইত্যাদি অম্ল।
HCl + H2O → H+(ag) + Cl- (ag)
ক্ষারক : যে সকল হাইড্রক্সি যৌগ জলীয় দ্রবনে হাইড্রোক্সিল আয়ন (OH-) দান করে তাদেরকে ক্ষারক বলে।
যেমন NaOH, KOH ইত্যাদি ক্ষারক।
KOH + H2O → K+(ag) + OH- (ag)
এ মতবাদের প্রধান ক্রটি হ'ল পানি অনুপস্থিতিতে এ সকল পদার্থের অম্ল বা ক্ষারকের ধর্ম ব্যাখ্যা করা যায় না।
এ মতবাদ অনুসারে ক্ষারক হতে গেলে জলিও দ্রবণে OH- আয়ন ত্যাগ করা বাধ্যতামূলক কিন্তু কিছু কিছু যেীগের ক্ষেত্রে আমরা এর ব্যতিক্রম দেখি। যেমন NH₃ কোন OH- না থাকা সত্বেও NH₃ একটি ক্ষারক।
এই তত্ত্ব অনুসারে, জলীয় দ্রবণে H⁺ আয়ন মুক্তভাবে অবস্থান করে। কিন্তু, জলীয় দ্রবণে, H⁺ আয়ন সর্বদা হাইড্রেটেড হয়ে হাইড্রোনিয়াম আয়ন তৈরি করে
H⁺ + H₂O ↔ H₃O ⁺(aq)
এই তত্ত্ব অনুসারে, একটি অ্যাসিডে অবশ্যই হাইড্রোজেন আয়ন (H⁺ আয়ন) থাকতে হবে এবং একটি ক্ষারকে অবশ্যই একটি হাইড্রক্সিল আয়ন (OH⁻) থাকতে হবে। কিন্তু এমন কিছু পদার্থ আছে যাদের জলীয় দ্রবণগুলি H⁺ বা OH⁻ আয়নসমূহ ব্যতীত অম্লীয় বা ক্ষারক প্রকৃতির।
যেমন: FeCl₃, CuSO₄, CO₂ জলীয় দ্রবণে অম্লতা প্রদর্শণ করে এবং NaNO₃, NH₃ জলীয় দ্রবণে ক্ষারিও প্রকৃতি প্রদর্শণ করে।
FeCl₃ + 3H₂O ↔ Fe (OH) ₃ + 3H₂O
অম্ল ও ক্ষারক সম্পর্কিত লুইস মতবাদ
লুইস মতবাদ অনুসারে অম্ল-ক্ষারক সম্পর্কিত মতবাদ নিম্নে বর্ণনা করা হল
অম্ল বা এসিড : যে সকল যৌগ বা আয়ন অন্য কোন যৌগ বা আয়ন থেকে এক জোড়া ইলেকট্রন গ্রহণ করতে
পারে তাকে অম্ল বা এসিড বলে। যেমন: H+, AlCl3, ইত্যাদি।
H+ + :NH3 → H+ ←. . NH3
অম্ল
সাধারণত: একটি যৌগে দাতা ও গ্রহীতার মধ্যে সন্নিবেশ সমযোজী বন্ধন সৃষ্টি হলে গ্রহীতা যৌগ বা আয়নকে অম্ল
বলে। ইলেকট্রন ঘাটতি যৌগ বা ধনাত্নক চার্জযুক্ত আয়নসমূহ এ মতবাদ অনুসারে অম্ল ধর্মী হয়।
ক্ষারক: যে সকল যৌগ বা আয়ন অন্য কোন যৌগ বা আয়নে এক জোড়া ইলেকট্রন দান করতে পারে তাকে
ক্ষারক বলে। যেমন :NH3, Cl- ,ইত্যাদি।
H+ + :NH3 → H+ ←. . NH3
ক্ষারক
সাধারণত: ঋণাত্নক চার্জযুক্ত যৌগ বা নিঃসঙ্গ ইলেকট্রন যুক্ত যৌগ এক জোড়া ইলেকট্রন দান করতে পারে বলে
এরা ক্ষারধর্মী হয়।
ব্রনস্টেড লোওরী তত্ত্ব
এসিড ও ক্ষারকের আধুনিক মতবাদগুলোর মধ্যে ব্রনষ্টেড লোউরী মতবাদই সরাসরি এসিড-ক্ষারক সাম্যাবস্থা
ব্যাখ্যা করে। এ মতবাদ অনুযায়ী যে সব পদার্থ প্রোটন দান করে তারাই এসিড এবং যে সব পদার্থ প্রোটন গ্রহন
করে তারাই ক্ষারক। এ সব পদার্থ চার্জযুক্ত বা চার্জবিহীনও হতে পারে। অর্থাৎ প্রোটন দান বা গ্রহণে সক্ষম দ্রাবক
নিরপেক্ষ বস্তুই এসিড বা ক্ষারক। প্রোটন দান বা গ্রহণের ক্ষমতার মাত্রা দ্বারা এর তীব্রতা নির্ণীত হয়। এ তত্ত্বকে
প্রোটনীয় তত্ত্বও বলা হয়।
উদাহরণ
HCl ও H2O- এর বিক্রিয়ায় দ্রবণে H3O- ও উৎপন্ন হয়
এ বিক্রিয়ায় HCl প্রোটন দান করেCl- পরিণত হয়েছে। তাই এখানে প্রোটন দাতা হিসেবে HClএসিড।
আবার H2O ঐ প্রোটন গ্রহণ করে হাইড্রোনিয়াম আয়ন (H3O + ) -এ পরিণত হয়েছে। সুতরাং প্রোটন গ্রহণে
সক্ষম বলে H2O একটি ক্ষারক। আবার উল্টা দিক থেকে H3O+ আয়ন প্রোটন ত্যাগ করে ও Cl- আয়ন
প্রোটন গ্রহণ করে। তাই H3O + আয়ন এসিড এবং Cl- আয়ন ক্ষারক। সুতরাং ব্রনস্টেড-লোউরী মতবাদ
অনুযায়ী নিচের সমীকরণ এসিড ক্ষারকের সম্পর্ক নির্দেশ করে।
HB= H + + B-
অর্থাৎ সাধারণভাবে, এসিড= প্রোটন + ক্ষারক
তাই, এসিড ও ক্ষারকের মধ্যে মূল সাংগঠনিক পার্থক্য হল মাত্র একটি প্রোটন।
অনুবন্ধী এসিড ও ক্ষারক (conjugate acid & base)
ব্রনস্টেড-লোওরী তত্ত্ব অনুযায়ী এসিড ক্ষারক-এর সাধারণ সমীকরণ নিম্নরূপে লেখা যায়:
HB= H + + B-
এই বিক্রিয়া অনুসারে HB একটি অম্ল কারণ এটি প্রোটন দান করে। আবার বিপরীত বিক্রিয়া অনুসারে B -
একটি ক্ষারক কারণ এটি প্রোটন গ্রহণ করে ঐই HB-তে পরিণত হয়। ঐইHBও B- পদার্থ দুটির মধ্যে শুধুমাত্র একটি
প্রোটনের পার্থক্য। এ ধরনের ক্ষেত্রে এসিড HB হল ক্ষারক B- এর অনুবন্ধী বা কনজুগেট এসিড এবং B-
আয়ন হল ঐই অম্লে র অনুবন্ধী ক্ষারক। তাই বলা যায়- -
কোন অম্ল থেকে একটি প্রোটন ত্যাগের ফলে যে ক্ষারক উৎপন্ন হয় তাকে সেই অম্লের অনুবন্ধী ক্ষারক বলা হয়।
আবার, কোন ক্ষারকের সাথে একটি প্রোটন সংযোগের ফলে যে এসিড উৎপন্ন হয় তাকে সেই ক্ষারকের অনুবন্ধী
অম্ল বলা হয়।
উদাহরণস্বরূপ
সুতরাং প্রতিটি এসিড প্রোটন দান করে ক্ষারকে পরিণত হচ্ছে এবং প্রতিটি ক্ষারক প্রোটন গ্রহণ করে অন্য একটি
এসিডে পরিণত হচ্ছে। অতএব দ্রবণে দুটি করে এসিড ও ক্ষারক সাম্যাবস্থায় বর্তমান থাকে। এদেরকে
পরস্পরের অনুবন্ধী যুগল বলে। যেমনঅনুবন্ধী যুগল
অনুবন্ধী যুগল
উলে খ্য যে, এসিড যদি শক্তিশালী হয় তবে তার অনুবন্ধী ক্ষারক হবে - দুর্বল এবং এসিড যদি দুর্বল হয় তবে তার
অনুবন্ধী ক্ষারক হবে শক্তিশালী। এভাবে, ক্ষারক যদি শক্তিশালী হয় তবে তার অনুবন্ধী এসিড হবে দুর্বল এবং
ক্ষারক যদি দুর্বল হয় তবে তার অনুবন্ধী এসিড হবে শক্তিশালী।

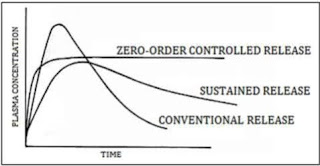
Comments
Post a Comment
Thanks